Lord Verine
Lord Verine adalah sebuah sebutan untuk kebangkitan atas dasar kekecewaan terhadap teman bahkan bukan lagi teman tapi sudah seperti saudara
lakukan lah kesenangan
ketika tugas seekolah mulai membuat kamu tidak nyaman maka cobalah hal yang tidak biasa dilakukan di jam les seperti yang kami lakukan ini silahkan tonton jangan ditiru cukup dikerjakan dan ditularkan :D
mohon maaf kepada pak guru tercinta just for reresing
mohon maaf kepada pak guru tercinta just for reresing
Prioritsas
dalam melakukan tugas kita sangat dituntut melakukanyya dengan cepaat dan cermat,terlepas itu pekerjaan berat dan ringan,kerjakan semuanya sesuai porsinya.
banyak dari kita sering dalam melakukan pekerjaanya dah bahkan salah dalam memprioritaskan apa yang hendak ia lakukan.
ilustrasi yang sederhana :
ada dua buah wadah ember sama besar, 2 onggok batu besar samabanyak,2 ongok kerikil sama banya,2 onggok pasir sama banyak dan 2 botol air sama banyak, tugas anda adalah memasukan semua item tersebut sebanyak satu onggok kedalam wadah ember.
nah sekarang kita lihat apa yang akan anda lakukan jika dihadapkan dengan permasaahan terdebut?
ada dua kemungkinan umum dari cara pandang orang melakukan tugasnya
1.sesuai petunjuk ketika ujian, kerjakan sola yang kamu anggap mudah terlebih dahulu,artinya anda mengerjakan hal yang mudah dan ringan terlebih dahulu.
2.poin pertama tidak berrlakuu bagi para pejuang yang suka tantangan, maka iaakan mengarjakan pekerjaanya dari yaang paling sulit dan paling berratt.
sekarang silahkan anda pikirkan mana ayng akan anda ikuti
1.kalau anda melakukan hal yang mudah terkebih dahulu, bearti anda meamsukan air terlebih dahulu kemudian pasir kerikil dan pada akhirnya untuk batu besar anda kewalahan karna sudah tidak muat dalam wadah tadi.
2.nah lain halnya dengan pilhan kedua ketika anda melakukan hal yang sulit terlebih dahulu ,artiinya anda memasukan baatu terlebih dahulu kemudian kerikil bisa menyelip diantara ruang kosong diantara batu besar kmudian pasir bisa meyelip daintara baatu da kerikil bahkan air masih bisa masuk
so prioritaskanlah hal yang leebih besar penting dan berat
banyak dari kita sering dalam melakukan pekerjaanya dah bahkan salah dalam memprioritaskan apa yang hendak ia lakukan.
ilustrasi yang sederhana :
ada dua buah wadah ember sama besar, 2 onggok batu besar samabanyak,2 ongok kerikil sama banya,2 onggok pasir sama banyak dan 2 botol air sama banyak, tugas anda adalah memasukan semua item tersebut sebanyak satu onggok kedalam wadah ember.
nah sekarang kita lihat apa yang akan anda lakukan jika dihadapkan dengan permasaahan terdebut?
ada dua kemungkinan umum dari cara pandang orang melakukan tugasnya
1.sesuai petunjuk ketika ujian, kerjakan sola yang kamu anggap mudah terlebih dahulu,artinya anda mengerjakan hal yang mudah dan ringan terlebih dahulu.
2.poin pertama tidak berrlakuu bagi para pejuang yang suka tantangan, maka iaakan mengarjakan pekerjaanya dari yaang paling sulit dan paling berratt.
sekarang silahkan anda pikirkan mana ayng akan anda ikuti
1.kalau anda melakukan hal yang mudah terkebih dahulu, bearti anda meamsukan air terlebih dahulu kemudian pasir kerikil dan pada akhirnya untuk batu besar anda kewalahan karna sudah tidak muat dalam wadah tadi.
2.nah lain halnya dengan pilhan kedua ketika anda melakukan hal yang sulit terlebih dahulu ,artiinya anda memasukan baatu terlebih dahulu kemudian kerikil bisa menyelip diantara ruang kosong diantara batu besar kmudian pasir bisa meyelip daintara baatu da kerikil bahkan air masih bisa masuk
so prioritaskanlah hal yang leebih besar penting dan berat
7 kegiatan yang tidak efektif
manusia selalu dihadapkan denga berrbagai masaah dalam kehidupannya, ada ayng mampu menyelesaikannya dengan bijak bahkan ada yang melakukan tugasnya tapi sama saja tidak melakuakn samaksekali.
berikut ada beberapa hal yang yang menjadi kebiasaan sebaggian orang dan sangat tidak efektif
berikut ada beberapa hal yang yang menjadi kebiasaan sebaggian orang dan sangat tidak efektif
Kebiasaan mana yang paling sering anda lakukan?
pentingnya komunikasi
Komunikasi adalah penentu lancarnya urusan anda,dengan komuniksi yanng baik pekerjaan anda lancar tapi jika terjadi kesalahan dalam berkomnikasi kegagalan dan perrtentangan sedang menunggu dipintu keluar bahkan memaksa anda meutup pintu dari luar,...
be care full
be care full
scroll touchpad tidak berfungsi
bagi sobat yagn sudsah terbiasa menggunakan touchpad scroll ketika menggunakn leptop akan sangat terganggu kalau tiba tiba benda ini tak berfungi,ternya ta carany untuk mengbalika fungsi dari scrolll ini sangt gampang
1.buka control panel
2.device and sound
3.pilih mouse
4.pilih propeties atau setting
5.centang pada scroll
taraaaa biasa digunakan seperti bisa lg
berdasar pengalaman sendiri sih
smoga membantu
1.buka control panel
2.device and sound
3.pilih mouse
4.pilih propeties atau setting
5.centang pada scroll
taraaaa biasa digunakan seperti bisa lg
berdasar pengalaman sendiri sih
smoga membantu
Cara Mempercepat Kinerja Laptop/Komputer dengan Mudah
leptop anda lelet? yok mari kita acak acak
Kemudian pilih aplikasi yang tidak penting kemudian klik "End Task".
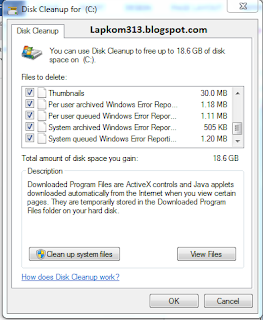
2. Disk Clean Up pada Hardisk. Ketika windows baru di install registry,cache,dan cookies masih blom ada, tapi setelah anda pakai untuk browsing dan lainnya semua itu akan menumpuk di hardisk anda yang akan membuat kinerja komputer/laptop menurun. Nah jadi silahkan hapus itu semua agar kinerja komputer maksimal. caranya sebagai berikut :
Klik start - all program - pilih accesories - system tool - dan Disk Clean Up.
Setelah itu akan tampil gambar seperti di atas, pilih partisi / disk yang akan anda bersihkan dan ok.
Nah kemudian centang semuanya dan klik ok.
3. Defragment Pada Hardisk Anda. Apa tujuan dari defrag hardisk? defrag hardisk yaitu bukan membersihkan ataupun menghapus file, melainkan menata ulang berkas-berkas yang ada pada hardisk agar si komputer/laptop bisa dengan mudah membacanya, jadi kinerjanya akan meningkat. Untuk defragment lakukan secara berkala seperti sebulan sekali atau 2 minggu sekali lebih bagus. caranya sebagai berikut :
Klik start - all program - accesories - klik system tool dan Disk Defragmenter.
Setelah itu akan muncul seperti gambar di atas. Pilih partisi mana yang ingin di defrag dan klik defrag lalu tunggu hingga prosesnya berahir.
4. Hapus Recent Places. Racent place merupakan histori atau jejak kita memakai komputer atau laptop yang akan di simpan di sana. Memang itu tidak penting dan harus di bersihkan untuk memaksimalkan kinerja komputer. Caraya sebagai berikut.
Masuk pada my computer - klik Recent place - hapus semua file.
5. Download Software Pembersih Ccleaner. Software ini akan membantu anda membersihkan sampah pada komputer anda hingga kinerjannya meningkat. Anda akan di mudahkan untuk membersikkannya dengan software ini dan ini adalah software gratis. silahkan download disini.
6. Lakukan Restart. Melakukan restart akan meningkatkan kinerja laptop atau komputer anda, jika terjadi hang atau komputer mulai lemot lakukan restart karena akan merefresh komputer anda, dan proses berjalan lancar kembali.
7. Minimalkan Startup. Aplikasi yang tidak penting akan menambah beban pada proses berfikir komputer atau laptop anda, jadi pastikan program/aplikasi yang penting saja yang berjalan pada awal komputer/laptop menyala (startup). caranya sebagai berikut :
Tekan pada keyboard anda "windows" + "R" secara bersamaan - ketik “msconfig” - Tekan "ok" - lalu pilih startup dan hilangkan centang aplikasi yang tidak penting seperti gambar di atas.
1. Matikal aplikasi yang tidak penting. Jika anda sedang memakai atau menyalakan komputer silahkan cek aplikasi yang sedang berjalan, dan tutup aplikasi anda yang tidak penting dengan cara tekan ( ctrl+Shift+Esc ) akan muncul seperti gambar di bawah.
2. Disk Clean Up pada Hardisk. Ketika windows baru di install registry,cache,dan cookies masih blom ada, tapi setelah anda pakai untuk browsing dan lainnya semua itu akan menumpuk di hardisk anda yang akan membuat kinerja komputer/laptop menurun. Nah jadi silahkan hapus itu semua agar kinerja komputer maksimal. caranya sebagai berikut :
Klik start - all program - pilih accesories - system tool - dan Disk Clean Up.
Nah kemudian centang semuanya dan klik ok.
3. Defragment Pada Hardisk Anda. Apa tujuan dari defrag hardisk? defrag hardisk yaitu bukan membersihkan ataupun menghapus file, melainkan menata ulang berkas-berkas yang ada pada hardisk agar si komputer/laptop bisa dengan mudah membacanya, jadi kinerjanya akan meningkat. Untuk defragment lakukan secara berkala seperti sebulan sekali atau 2 minggu sekali lebih bagus. caranya sebagai berikut :
Setelah itu akan muncul seperti gambar di atas. Pilih partisi mana yang ingin di defrag dan klik defrag lalu tunggu hingga prosesnya berahir.
4. Hapus Recent Places. Racent place merupakan histori atau jejak kita memakai komputer atau laptop yang akan di simpan di sana. Memang itu tidak penting dan harus di bersihkan untuk memaksimalkan kinerja komputer. Caraya sebagai berikut.
5. Download Software Pembersih Ccleaner. Software ini akan membantu anda membersihkan sampah pada komputer anda hingga kinerjannya meningkat. Anda akan di mudahkan untuk membersikkannya dengan software ini dan ini adalah software gratis. silahkan download disini.
6. Lakukan Restart. Melakukan restart akan meningkatkan kinerja laptop atau komputer anda, jika terjadi hang atau komputer mulai lemot lakukan restart karena akan merefresh komputer anda, dan proses berjalan lancar kembali.
7. Minimalkan Startup. Aplikasi yang tidak penting akan menambah beban pada proses berfikir komputer atau laptop anda, jadi pastikan program/aplikasi yang penting saja yang berjalan pada awal komputer/laptop menyala (startup). caranya sebagai berikut :
termodinamika
ENTROPI
Entropi adalah fungsi keadaan, dan merupakan kriteria yang menentukan apakah suatu keadaan dapat dicapai dengan spontan dari keadaan lain. (Taro Saito, Kimia Anorganik 1 hal. 42)
Entropi merupakan besaran termodinamika yang menyatakan derajat ketidakteraturan partikel. Jika sistem kemasukan kalor, maka entropi bertambah., dan sebaliknya jika kalor keluar maka entropi berkurang. Menentukan entropi (S) suatu sistem tidak mudah karena menyangkut energi yang di kandungnya. Akan tetapi besarnya perbahan entropi (DS) dalam suatu peristiwa dapat di hitung dari besarnya kalor yang masuk atau yang keluar. Kalor dapat menambah ketidakteraturan (entropi) partikel sistem, tetapi perubahan itu tidak linier, dan bergantung pada suhu sistem. Seperti energi dalam (U) dan entalpi (H), Entropi adalah besaran termodinamika yang nilainya tergantung pada keadaan awal dan keadaan akhir dan tidak di pengaruhi oleh jalan yang di tempuh. Oleh sebab itu, ΔS proses reversibel sama dengan irreversibel walaupun kalor yang di serap tidak sama.
qir = ΔU + P (V2 – V1)
Perubahan entropi suatu proses di hitung dari qr dan bukan dari qir, baik prosesnya reversibel maupun irreversibel.
ΔS = qr/T
Karena qr lebih besar dari qir maka dalam proses irreversibel :
ΔS > qir/T
(syukri, Kimia Dasar 1. Hal 99-100)
Hukum ke-2 termodinamika menyatakan bahwa entropi, S, sistem yang terisolasi dalam proses spontan meningkat. Dinyatakan secara matematis
ΔS > 0 (Taro Saito, Kimia Anorganik 1 hal. 43)
ΔS > 0, prosesnya irreversibel = spontan
ΔS = 0, prosesnya reversibel = kesetimbangan
ΔS ≥ 0, prosesnya alami yakni irreversibel atau reversibel = tidak spontan.
Jika suhu di turunkan terus menerus,mengakibatkan entropi makin lama makin mengecil. Dalam dunia keilmuan, suhu terendah adalah 0 K sehingga di asumsikanpada suhu ini zat murni tersusun paling teratur. Berdasarkan asumsi itu, di sepakati suatu perjanjian yang di sebut hukum ketiga termodinamika. Berdasarkan hukum ini di lakukan pengukuran dan perhitungan kalor yang di serap suatu zat murni dari suhu 0 K sampai suhu tertentu. Akhirnya di hitung entropi zat tersebut pada suhu 250 C dan tekanan 1 atm yang di sebut entropi standar. Dengan adanya entropi standar, dapat di hitung nilai dari ΔSsebuah reaksi anorganik.
ΔS = Σ entropi produk – Σ entropi reaktan
(syukri, Kimia Dasar 1. Hal 104)
Energi bebas GiBBs (G)
Untuk menyatakan reaksi yang berjalan spontan, maka di gunakan fungsi termodinamika yang lain yaitu Energi Bebas Gibbs atau dapat di sebut juga sebagai energi bebas. (olimpiade kimia SMA, hal 66)
Energi bebas suatu sistem adalah selisih entalpi dengan temperatur yang di kalikan dengan entropi.
G = H – TS
Sehingga perubahan energi bebas pada suhu konstan adalah ;
ΔG = ΔH – TΔS
Dan pada keadaan standar, energi bebas dapat di hitung dengan persamaan ;
ΔG0 = ΔH0 – TΔS0
Energi bebas dalam keadaan standar telah di ukur untuk setiap senyawa dan telah di tabulasikan secara global sehingga perubahan energi gibbs (ΔG) suatu reaksi anorganik, dapat di hitung dengan rumus :
ΔG0= Σ ΔGf0produk - Σ ΔGf0reaktan
Dari persamaan tersebut dapat di ketahui hal-hal seperti berikut ;
ΔG < 0, reaksi berjalan secara spontan
ΔG > 0, reaksi berjalan tidak spontan
ΔG = 0 , reaksi dalam keadaan setimbang
Termodinamika
Dalam pembahasan termodinamika sebaiknya kita mencoba mencermati sistem dan lingkungan. Jika suatu reaksi menghasilkan energi, maka energi mengalir dari sistem ke lingkungan. Demikian pula jika reaksi membutuhkan energi, energi akan mengalir dari lingkungan ke system (Gambar 10.22). Sehingga jelas bahwa energi yang lepas sama dengan energi yang diterima, tidak ada energi yang hilang merupakan prinsip kekekalan energi atau hukum pertama termodinamika.
Gambar 10.22. Sistem dan lingkungan dan hubungan antara kalor, energi dalam dan entalphi
Jika sistem menyerap energi/kalor, maka sebagian energi dipergunakan untuk melakukan kerja (W), seperti menyeimbangkan dengan keadaan luar. Sebagian lagi disimpan dalam sistem dan dipergunakan untuk penyusunan atau penataan atom-atom dalam reaksi kimia. Energi yang disimpan ini disebut dengan Energi dalam dengan lambang E.
Jika sebuah sistem menyerap energi dan tidak melakukan usaha, maka energi/kalor yang diserap sama dengan Energi dalam, dalam hal ini
q = ΔE
Jika energi yang diserap dipergunakan untuk melakukan usaha dan juga untuk perubahan kimia, maka total energi yang dipergunakan sebesar W yang setara dengan pV. Juga digunakan untuk reaksi kimia sebesar E, kuantitas energi ini dikenal dengan Entalphi (H), sehingga H = E + pV (Gambar 10.21). Kalor atau energi yang diserap pada tekanan tetap setara dengan;
q = ΔH
q = ΔE
Jika energi yang diserap dipergunakan untuk melakukan usaha dan juga untuk perubahan kimia, maka total energi yang dipergunakan sebesar W yang setara dengan pV. Juga digunakan untuk reaksi kimia sebesar E, kuantitas energi ini dikenal dengan Entalphi (H), sehingga H = E + pV (Gambar 10.21). Kalor atau energi yang diserap pada tekanan tetap setara dengan;
q = ΔH
pembahasan Hukum Termodinamika
1. a. Jelaskan konsep dasar Hukum Termodinamika II!
b. Jelaskan bagaimankah ketidaksamaan Clausius!
2. Bagaimanakah hubungan antara Hukum Termodinamika I dan II!
3. Tentukan entalpi penguapan molar dari karbon tetraklorida yang titik didihnya 76,7oC sesuai aturan Trouton!
4. Tentukan ∆S dari penguapan 1 mol air pada 100oC yang mempunyai kalor 40.700 J/mol!
5. Tentukan perubahan entropi suatu gas Argon pada temperatur 25oC dan tekanan 1 atm dalam wadah dengan volume 500 cm3 yang dimampatkan hingga 50 cm3 dan didinginkan sampai -25oC!
6. Entalpi transisi fase grafit -> intan yang pada tekanan 1 atm pada temperatur 2000 K adalah 1,9 kJ/mol. Tentukan perubahan transisi entropi tersebut!
1. a. Konsep Dasar Hukum Termodinamika II
Hukum Termodinamika II menyatakan bahwa kondisi-kondisi alam selalu mengarah kepada ketidakteraturan; seluruh alam semesta bergerak menuju keadaan yang semakin tidak teratur, tidak terencana. Secara filosofis, pada kehidupan sehari-hari dalam suatu sistem tertutup tanpa campur tangan dari luar mengakibatkan ketidakteraturan akan semakin bertambah dalam proses yang berlangsung spontan. Entropi alam semesta merupakan entropi lingkungan dan entropi sistem, entropi digunakan untuk menyatakan ketidakteraturan.
∆S univ = ∆S sur + ∆S sys > 0
b. Ketidaksamaan Clausius
Secara umum, perubahan keadaan disertai dengan perubahan entropi sistem (dS) dan perubahan entropi lingkungannya (dS’). Perubahan entropi keseluruhan bernilai lebih dari nol karena prosesnya mungkin tak reversibel:
dS + dS’ ≥ 0 atau dS ≥ -dS’
Karena  dengan dq adalah kalor yang diberikan kepada sistem, maka untuk setiap perubahan
dengan dq adalah kalor yang diberikan kepada sistem, maka untuk setiap perubahan 
2. Hubungan Hukum Termodinamika I dan II
Pada Hukum Termodinamika I, pada sistem tertutup perubahan energi dalam setara dengan panas yang diberikan pada sistem (q) dan kerja yang dilakukan terhadap sistem (w):
dU = dq + dw atau ∆U = q + w ……………………………… (1)
dimana kerja yang dilakukan sistem:
dw = - P. dV ………………………………………………………… (2)
Pada Hukum Termodinamika II, besarnya entropi setara dengan kalor dan berbanding terbalik dengan suhu:
dari persamaan (1), (2), dan (3) didapatkan hubungan sebagai berikut:
dU = dq + dw
dU = T . dS – P . dV
Persamaan tersebut berlaku pada segala perubahan reversibel dan irreversibel dari sistem tertutup. Penggabungan Hukum Termodinamika I dan II disebut Persamaan Fundamental.
3. Diketahui:
Tb = 76,7oC = 349,7 K
Ditanya:
∆H vap CCl4 = ?
Jawab:
∆H vap = Tb × 85 J K-1 mol-1
= 349,7 K × 85 J K-1 mol-1
= 29,665 kJ/mol
4. Diketahui:
n H2O = 1 mol
T = 100oC = 373 K
q = 40.700 J/mol
Ditanya:
∆S penguapan = ?
Jawab:
= 109,12 J K-1 mol-1
5. Diketahui:
Ti = 25oC = 298 K
P = 1 atm
Vi = 500 cm3 = 500 . 10-3 L
Vf = 50 cm3 = 50 . 10-3 L
Tf = -25oC = 248 K
Ditanya:
∆S gas argon = ?
Jawab:
P . V = n . R . T
1 atm . 0,5 L = n . 8,206 . 10-2 L atm K-1 mol-1 . 298 K
0,5 = 24,45 n mol-1
n
n
= 0,0204 mol
∆S total = ∆S1 + ∆S2
= -0,39 J K-1 + (-0,047 J K-1)
= -0,437 J K-1
6. Diketahui:
P = 1 atm
T = 2000 K
∆H trans = 1,9 kJ/mol
Ditanya:
∆S trans = ?
Jawab:
Termodinamika
Rumus Dasar Termodinamika
Hukum Termodinamika I
ΔU = Q − W
Keterangan :
ΔU = perubahan energi dalam (joule)
Q = kalor (joule)
W = usaha (joule)
Proses-proses
Isobaris → tekanan tetap
Isotermis → suhu tetap → ΔU = 0
Isokhoris → volume tetap (atau isovolumis atau isometric) → W = 0
Adiabatis → tidak terjadi pertukaran kalor → Q = 0
Siklus → daur → ΔU = 0
Persamaan Keadaan Gas
Hukum Gay-Lussac
Tekanan tetap → V/T = Konstan → V1/T1 = V2/T2
Hukum Charles
Volume tetap → P/T = Konstan → P1/T1 = P2/T2
Hukum Boyle
Suhu tetap → PV = Konstan → P1V1 = P2V2
P, V, T Berubah (non adiabatis)
(P1V1) / (T1) = (P2V2) / (T2)
Adiabatis
P1V1 γ= P2V2γ
T1V1 γ − 1= T2V2γ − 1
γ = perbandingan kalor jenis gas pada tekanan tetap dan volum tetap → γ = Cp/Cv
Usaha
W = P(ΔV) → Isobaris
W = 0 → Isokhoris
W = nRT ln (V2 / V1) → Isotermis
W = − 3/2 nRΔT → Adiabatis ( gas monoatomik)
Keterangan :
T = suhu (Kelvin, jangan Celcius)
P = tekanan (Pa = N/m2)
V = volume (m3)
n = jumlah mol
1 liter = 10−3m3
1 atm = 105 Pa ( atau ikut soal!)
Jika tidak diketahui di soal ambil nilai ln 2 = 0,693
Mesin Carnot
η = ( 1 − Tr / Tt ) x 100 %
η = ( W / Q1 ) x 100%
W = Q1 − Q2
Keterangan :
η = efisiensi mesin Carnot (%)
Tr = suhu reservoir rendah (Kelvin)
Tt = suhu reservoir tinggi (Kelvin)
W = usaha (joule)
Q1 = kalor masuk / diserap reservoir tinggi (joule)
Q2 = kalor keluar / dibuang reservoir rendah (joule)
Diktat Termodinakiaka Teknik Mesin
termodinamika 2
Termodinamika 1
Termodinamika Entropy
Aplikasi TErmodinamika
Contoh Soal dan Pembahasan
Soal No. 1
Suatu gas memiliki volume awal 2,0 m3 dipanaskan dengan kondisi isobaris hingga volume akhirnya menjadi 4,5 m3. Jika tekanan gas adalah 2 atm, tentukan usaha luar gas tersebut!
(1 atm = 1,01 x 105 Pa)
Pembahasan
Data :
V2 = 4,5 m3
V1 = 2,0 m3
P = 2 atm = 2,02 x 105 Pa
Isobaris → Tekanan Tetap
W = P (ΔV)
W = P(V2 − V1)
W = 2,02 x 105 (4,5 − 2,0) = 5,05 x 105 joule
Soal No. 2
1,5 m3 gas helium yang bersuhu 27oC dipanaskan secara isobarik sampai 87oC. Jika tekanan gas helium 2 x 105 N/m2 , gas helium melakukan usaha luar sebesar....
A. 60 kJ
B. 120 kJ
C. 280 kJ
D. 480 kJ
E. 660 kJ(Sumber Soal : UMPTN 1995)
Pembahasan
Data :
V1 = 1,5 m3
T1 = 27oC = 300 K
T2 = 87oC = 360 K
P = 2 x 105 N/m2
W = PΔV
Mencari V2 :
V2/T2 = V1/T1
V2 = ( V1/T1 ) x T2 = ( 1,5/300 ) x 360 = 1,8 m3
W = PΔV = 2 x 105(1,8 − 1,5) = 0,6 x 105 = 60 x 103 = 60 kJ
Soal No. 3
2000/693 mol gas helium pada suhu tetap 27oC mengalami perubahan volume dari 2,5 liter menjadi 5 liter. Jika R = 8,314 J/mol K dan ln 2 = 0,693 tentukan usaha yang dilakukan gas helium!
Pembahasan
Data :
n = 2000/693 mol
V2 = 5 L
V1 = 2,5 L
T = 27oC = 300 K
Usaha yang dilakukan gas :
W = nRT ln (V2 / V1)
W = (2000/693 mol) ( 8,314 J/mol K)(300 K) ln ( 5 L / 2,5 L )
W = (2000/693) (8,314) (300) (0,693) = 4988,4 joule
Soal No. 4
Mesin Carnot bekerja pada suhu tinggi 600 K, untuk menghasilkan kerja mekanik. Jika mesin menyerap kalor 600 J dengan suhu rendah 400 K, maka usaha yang dihasilkan adalah....
A. 120 J
B. 124 J
C. 135 J
D. 148 J
E. 200 J(Sumber Soal : UN Fisika 2009 P04 No. 18)
Pembahasan
η = ( 1 − Tr / Tt ) x 100 %
Hilangkan saja 100% untuk memudahkan perhitungan :
η = ( 1 − 400/600) = 1/3
η = ( W / Q1 )
1/3 = W/600
W = 200 J
Soal No. 5
Diagram P−V dari gas helium yang mengalami proses termodinamika ditunjukkan seperti gambar berikut!

Usaha yang dilakukan gas helium pada proses ABC sebesar....
A. 660 kJ
B. 400 kJ
C. 280 kJ
D. 120 kJ
E. 60 kJ(Sumber Soal : UN Fisika 2010 P04 No. 17)
Pembahasan
WAC = WAB + WBC
WAC = 0 + (2 x 105)(3,5 − 1,5) = 4 x 105 = 400 kJ
Soal No. 6
Suatu mesin Carnot, jika reservoir panasnya bersuhu 400 K akan mempunyai efisiensi 40%. Jika reservoir panasnya bersuhu 640 K, efisiensinya.....%
A. 50,0
B. 52,5
C. 57,0
D. 62,5
E. 64,0(Sumber Soal : SPMB 2004)
Pembahasan
Data pertama:
η = 40% = 4 / 10
Tt = 400 K
Cari terlebih dahulu suhu rendahnya (Tr) hilangkan 100 % untuk mempermudah perhitungan:
η = 1 − (Tr/Tt)
4 / 10 = 1 − (Tr/400)
(Tr/400) = 6 / 10
Tr = 240 K
Data kedua :
Tt = 640 K
Tr = 240 K (dari hasil perhitungan pertama)
η = ( 1 − Tr/Tt) x 100%
η = ( 1 − 240/640) x 100%
η = ( 5 / 8 ) x 100% = 62,5%
Soal No. 7
Perhatikan gambar berikut ini!

Jika kalor yang diserap reservoir suhu tinggi adalah 1200 joule, tentukan :
a) Efisiensi mesin Carnot
b) Usaha mesin Carnot
c) Perbandingan kalor yang dibuang di suhu rendah dengan usaha yang dilakukan mesin Carnot
d) Jenis proses ab, bc, cd dan da
Pembahasan
a) Efisiensi mesin Carnot
Data :
Tt = 227oC = 500 K
Tr = 27oC = 300 K
η = ( 1 − Tr/Tt) x 100%
η = ( 1 − 300/500) x 100% = 40%
b) Usaha mesin Carnot
η = W/Q1
4/10 = W/1200
W = 480 joule
c) Perbandingan kalor yang dibuang di suhu rendah dengan usaha yang dilakukan mesin Carnot
Q2 = Q1 − W = 1200 − 480 = 720 joule
Q2 : W = 720 : 480 = 9 : 6 = 3 : 2
d) Jenis proses ab, bc, cd dan da
ab → pemuaian isotermis (volume gas bertambah, suhu gas tetap)
bc → pemuaian adiabatis (volume gas bertambah, suhu gas turun)
cd → pemampatan isotermal (volume gas berkurang, suhu gas tetap)
da → pemampatan adiabatis (volume gas berkurang, suhu gas naik)
Soal No. 8

Suatu gas ideal mengalami proses siklus seperti pada gambar P − V di atas. Kerja yang dihasilkan pada proses siklus ini adalah....kilojoule.
A. 200
B. 400
C. 600
D. 800
E. 1000
Pembahasan
W = Usaha (kerja) = Luas kurva siklus = Luas bidang abcda
W = ab x bc
W = 2 x (2 x 105) = 400 kilojoule
Langganan:
Komentar (Atom)