ntah apa la tgasnya mngkin ada dfinisi lain
tgas buk wet
Natrium hidroksida NaOH
mengutip dari wikipedia salah satu kalimatnya ada mengatakan bahwa NaoH dapat bereaksi dengan Carbon dioksida, nah dlam hal ini lebih tepatnya menyerap karbon dioksida, knpa tidak digunakan aja pas musim asap kmaren yaa??
ini sih nalur orang awam kyak kita kita ni, bantu jwab ya sahabat
| Natrium Hidroksida | |
|---|---|
 | |
 | |
Natrium Hidroksida
| |
Nama lain[sembunyikan]
Soda kaustik
| |
| Identifikasi | |
| Nomor CAS | [1310-73-2] |
| Sifat | |
| Rumus molekul | NaOH |
| Massa molar | 39,9971 g/mol |
| Penampilan | zat padat putih |
| Densitas | 2,1 g/cm³, padat |
| Titik lebur | 318 °C (591 K) |
| Titik didih | 1390 °C (1663 K) |
| Kelarutan dalam air | 111 g/100 ml (20 °C) |
| Kebasaan (pKb) | -2,43 |
| Bahaya | |
| MSDS | External MSDS |
| NFPA 704 | |
| Titik nyala | Tidak mudah terbakar. |
| Senyawa terkait | |
| Alkali hidroksida terkait | Litium hidroksida Kalium hidroksida Rubidium hidroksida Sesium hidroksida |
| Kecuali dinyatakan lain, data di atas berlaku pada temperatur dan tekanan standar (25°C, 100 kPa) | |
Natrium hidroksida (NaOH), juga dikenal sebagai soda kaustik, soda api, atau sodium hidroksida, adalah sejenis basa logam kaustik. Natrium Hidroksida terbentuk dari oksida basa Natrium Oksida dilarutkan dalam air. Natrium hidroksida membentuk larutanalkalin yang kuat ketika dilarutkan ke dalam air. Ia digunakan di berbagai macam bidang industri, kebanyakan digunakan sebagai basa dalam proses produksi bubur kayu dan kertas, tekstil, air minum, sabun dan deterjen. Natrium hidroksida adalah basa yang paling umum digunakan dalam laboratorium kimia.
Natrium hidroksida murni berbentuk putih padat dan tersedia dalam bentuk pelet, serpihan, butiran ataupun larutan jenuh 50% yang biasa disebut larutan Sorensen. Ia bersifat lembap cair dan secara spontan menyerap karbon dioksida dari udara bebas. Ia sangat larut dalam air dan akan melepaskan panas ketika dilarutkan, karena pada proses pelarutannya dalam air bereaksi secara eksotermis. Ia juga larut dalam etanol dan metanol, walaupun kelarutan NaOH dalam kedua cairan ini lebih kecil daripada kelarutanKOH. Ia tidak larut dalam dietil eter dan pelarut non-polar lainnya. Larutan natrium hidroksida akan meninggalkan noda kuning pada kain dan kertas.
Larutan Baku (Standar)
Larutan baku/ larutan standar adalah larutan yang konsentrasinya sudah diketahui. Larutan baku biasanya berfungsi sebagai titran sehingga ditempatkan buret, yang sekaligus berfungsi sebagai alat ukur volume larutan baku. Larutan yang akan ditentukan konsentrasinya atau kadarnya, diukur volumenya dengan menggunakan pipet volumetri dan ditempatkan di erlenmeyer.
a. Larutan baku primer
Larutan yang mengandung zat padat murni yang konsentrasi larutannya diketahui secara tepat melalui metode gravimetri (perhitungan massa), dapat digunakan untuk menetapkan konsentrasi larutan lain yang belum diketahui. Nilai konsentrasi dihitung melalui perumusan sederhana, setelah dilakukan penimbangan teliti dari zat pereaksi tersebut dan dilarutkan dalam volume tertentu.
Contoh: K2Cr2O7, As2O3, NaCl, asam oksalat, asam benzoat.
Syarat-syarat larutan baku primer :
§ Zat harus mudah diperoleh, dimurnikan, dikeringkan (jika mungkin pada suhu 110-120 derajat celcius) dan disimpan dalam keadaan murni. (Syarat ini biasanya tak dapat dipenuhi oleh zat- zat terhidrasi karena sukar untuk menghilangkan air-permukaan dengan lengkap tanpa menimbulkan pernguraian parsial.)
§ Zat harus tidak berubah berat dalam penimbangan di udara; kondisi ini menunjukkan bahwa zat tak boleh higroskopik, tak pula dioksidasi oleh udara atau dipengaruhi karbondioksida.
§ Zat tersebut dapat diuji kadar pengotornya dengan uji- uji kualitatif dan kepekaan tertentu.
§ Zat tersebut sedapat mungkin mempunyai massa relatif dan massa ekuivalen yang besar.
§ Zat tersebut harus mudah larut dalam pelarut yang dipilih.
§ Reaksi yang berlangsung dengan pereaksi harus bersifat stoikiometrik dan langsung.
b. Larutan baku sekunder
Larutan suatu zat yang konsentrasinya tidak dapat diketahui dengan tepat karena berasal dari zat yang tidak pernah murni. Konsentrasi larutan ini ditentukan dengan pembakuan menggunakan larutan baku primer, biasanya melalui metode titrimetri. Contoh: AgNO3, KmnO4, Fe(SO4)2
Syarat-syarat larutan baku sekunder :
· Derajat kemurnian lebih rendah daripada larutan baku primer
· Mempunyai berat ekivalen yang tinggi untuk memperkecil kesalahan penimbangan
· Larutannya relatif stabil dalam penyimpanan.
Indikator Asam Basa
Jika kita ingin mengetahui apakah suatu senyawa bersifat asam, basa atau bahkan tidak keduanya cara yang paling mudah dan murah adalah dengan kertas lakmus. Apa itu lakmus? Lakmus berasal dari kata litmus yaitu sejenis tanaman yang dapat menghasilkan warna jika ada asam atau basa. Lakmus merupakan asam lemah, dan biasa ditulis sebagai Hlit. Ketika dalam air terbentuk :
HLit →H+(aq) + Lit– (aq)
Ketika berbentuk Hlit, berwarna merah dan ketika berbentuk ion berwarna biru. Untuk mengetahui bagaimana reaksinya ketika ada asam atau basa, maka kita gunakan asas Le Chatelier.
Trayek pH beberapa indikator diantaranya :
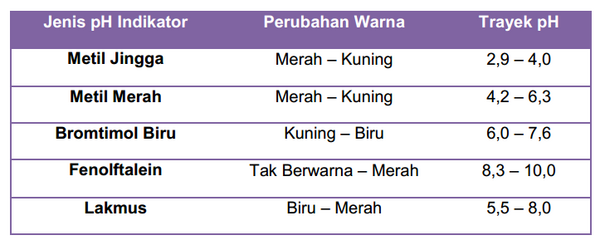

Tabel Perubahan warna dan trayek pH indikator asam basa
Penggunaan beberapa buah indikator untuk mengetahui pH satu jenis larutan dinilai kurang efektif, karena banyaknya zat, memerlukan biaya cukup mahal untuk diidentifikasi keasamannya. Untuk itu dibuatlah indikator universal, yang secara praktis menunjukkan warna tertentu untuk nilai pH tertentu. Indikator ini pundapat dibuat dalam bentuk lembaran kertas yang efisien.
Indikator asam-basa yang paling sering digunakan adalah kertas lakmus. Ada dua macam kertas lakmus, yaitu biru dan merah. Kertas lakmus biru akan berubah warna menjadi merah ketika bertemu dengan senyawa asam dan tidak berubah warna jika bertemu senyawa basa. Sebaliknya, kertas lakmus merah akan berubah warna menjadi biru ketika bertemu dengan senyawa basa dan tidak berubah warna ketika bertemu dengan senyawa asam. Ketika kedua jenis kertas lakmus digunakan pada suatu senyawa dan tidak terjadi perubahan di keduanya, maka senyawa tersebut bersifat netral.
✪ Kertas Lakmus ✪
Biru → Biru → Basa
Biru → Merah → Asam
Merah → Merah → Asam
Merah → Biru → Basa
Contoh
✽ Contoh 1 ✽
Suatu larutan menunjukkan perubahan warna menjadi jingga kemerahan ketika diberi indikatormetil merah. pH larutan tersebut memiliki kisaran antara .…
Penyelesaian:
Indikator metil merah memiliki trayek pH 4,2 – 6,3 dengan perubahan warna merah – kuning. Warna larutan setelah pemberian indikator adalah jingga kemerahan. Oleh karena itu kemungkinan pHnya ada di antara trayek pH metil merah. pH warna jingga merupakan nilai tengah trayek pH indikator tersebut yaitu
pH=(4,2+6,3)2=10,52=5,25
warna jingga kemerahan menunjukkan bahwa pH larutan lebih mendekati warna asam yang menjadi batas bawah trayek pH metil merah, sehingga perkiraan atau kisaran pH larutan tersebut adalah 4,2 – 5,25.
✽ Contoh 2 ✽
Suatu larutan tidak menunjukkan adanya perubahan warna ketika diberi indikator fenolftalein (PP). Akan tetapi berubah warna menjadi biru ketika menggunakan indikator bromtimol biru. Larutan tersebut memiliki pH pada kisaran .…
Penyelesaian:
Indikator fenolftalein (PP) memiliki trayek pH 8,3 – 10,0 dengan perubahan tak berwarna – merah. Warna larutan setelah pemberian indikator PP adalah tak berwarna, sehingga kemungkinan pHnya di bawah 8,3.
Indikator bromtimol biru memiliki trayek pH 6,0 – 7,6 dengan perubahan warna kuning – biru. Warna larutan setelah pemberian indikator adalah biru, sehingga kemungkinan pHnya melebihi batas atas trayek pH metil merah yaitu 7,6.
Dari kedua hasil indikator tersebut dapat disimpulkan bahwa pH larutan berada pada kisaran7,6 – 8,3.
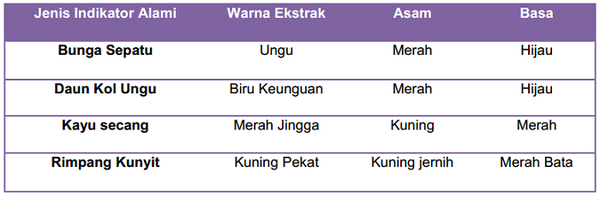
pH indikator juga bisa didapatkan dari bahan alam seperti daun, bunga dan batang. Bahan-bahan alam alam yang dapat digunakan sebagai pH indikator inilah yang disebut sebagai pH indikator alami. pH indikator alami ini tidak memiliki trayek pH tertentu. pH indikator alami hanya bisa membedakan antara asam dan basa dari perubahan warna saja layaknya kertas lakmus. Bahan-bahan yang sering digunakan sebagai indikator alami biasanya memiliki warna-warna yang mencolok seperti bunga sepatu (Hibiscus rosa-sinensis, L), kol ungu (Brassica oleracea, L), kayu secang (Caesalpinia sappan), dan kunyit (Curcuma domestica, Val).
Berikut ini adalah jenis perubahan warna yang diberikan oleh pH indikator alami terhadap asam dan basa.

Poin Penting
- Pengukuran pH dapat dilakukan dengan menggunakan pH meter atau pH indikator.
- pH indikator memiliki trayek masing-masing sesuai dengan tingkat kepekaannya terhadap perubahan pH yang ditandai dengan perubahan warna.
ikatan sigma
Dalam kimia, ikatan sigma (ikatan σ) adalah sejenis ikatan kimia kovalen yang paling kuat. Ikatan sigma dapat dijelaskan dengan jelas untuk molekul diatomik menggunakan konsep grup simetri. Dalam pendekatan formal ini, ikatan σ adalah simetris terhadap rotasi di sumbu ikat. Dengan definisi ini, bentuk ikatan sigma yang umum adalah s+s, pz+pz, s+pz, dan dz2+dz2 (z ditentukan sebagai sumbu ikat). Teori kuantum juga mengatakan bahwa orbital molekul (MO) yang bersimetri sama akan bercampur. Konsekuensi dari percampuran molekul diatomik ini adalah fungsi gelombang orbital molekul s+s dan pz+pz menyatu. Ruang lingkup percampuran ini tergantung pada energi relatif dari MO yang bersimetri.
Untuk molekul homodiatomik. orbital σ yang berikatan tidak memiliki bidang simpul di antara atom-atom yang berikatan. Antiikat atau orbital σ* ditentukan dengan keberadaan sebuah bidang simpul antara dua atom yang berikatan ini.
Oleh karena ikatan sigma adalah jenis ikatan kovalen yang paling kuat, elektron-elektron dalam ikatan ini kadang-kadang dirujuk sebagai elektron sigma.
Simbol σ adalah huruf Yunani untuk s. Ketika ikatan ini dilihat dari atas, MO σ mirip dengan orbital atom s.
Ikatan sigma dalam senyawa poliatomik
Ikatan sigma ini didapatkan dari orbital-orbital atom yang tumpang tindih. Konsep ikatan sigma diperluas untuk menjelaskan interaksi ikatan yang melibatkan ketumpangtindihan cuping tunggal sebuah orbital dengan cuping tunggal lainnya. Sebagai contoh, propana dideskripsikan mengandung 10 ikatan sigma, masing-masing untuk dua ikatan C-C dan delapan ikatan C-H. Ikatan σ pada molekul poliatomik ini sangat ter-delokalisasi dan berlawanan dengan konsep dua orbital satu ikatan. Terlepas dari masalah ini, konsep ikatan σ sangatlah berguna, sehingga digunakan secara luas.
Ikatan sigma dalam senyawa yang berikatan rangkap banyak[sunting | sunting sumber]
Senyawa-senyawa yang memiliki ikatan rangkap, seperti etilena dan kromium(II) asetat memiliki ikatan sigma di antara ikatan rangkap tersebut. Ikatan sigma ini ditambahi dengan ikatan π seperti pada etilena dan bahkan dengan ikatan &delta seperti pada kasus kromium(II) asetat untuk membentuk ikatan rangkap.


Ikatan pi
Dalam kimia, ikatan pi (ikatan π) adalah ikatan kimia kovalen yang dua cuping orbital atom yang berlektron tunggal bertumpang tindih dengan dua cuping orbital atom lainnya yang juga berlektron tunggal. Hanya terdapat satu bidang simpul dari orbital yang melewati dua inti atom.
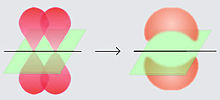
Huruf Yunani π berasal dari nama orbital p karena simetri orbital ikatan pi adalah sama dengan orbital p ketika dilihat dari sumbu ikatan. Orbital p biasanya terlibat dalam ikatan sejenis ini. Orbital d juga dianggap terlibat dalam ikatan pi, namun tidaklah seperlunya benar, walaupun konsep ikatan orbital d sesuai dengan hipervalensi.
Ikatan pi biasanya lebih lemah dari ikatan sigma karena rapatan elektronnya lebih jauh dari inti atom yang bermuatan positif, sehingga memerlukan lebih banyak energi. Dari sudut pandang mekanika kuantum, kelemahan ikatan ini dijelaskan oleh ketumpangtindihan yang sangat sedikit di antara orbital p oleh karena orientasinya yang paralel.
Walaupun ikatan pi lebih lemah dari ikatan sigma, ikatan pi seringkali merupakan komponen dari ikatan rangkap bersamaan dengan ikatan sigma. Kombinasi dari ikatan sigma dan pi lebih kuat dari ikatan pi dan sigma yang berdiri sendiri. Kekuatan ikatan yang bertambah dari ikatan rangkap diindikasikan oleh banyak pengamatan, namun yang paling menonjol adalah kontraksi panjang ikatan. Sebagai contoh, dalam kimia organik, panjang ikat karbon-karbon pada etana adalah 154 pm, etilena 133 pm, dan asetilena 120 pm.
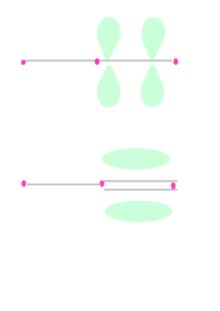

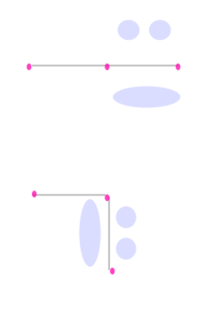
Selain ikatan sigma, sebuah pasangan atom yang dihubungkan dengan ikatan rangkap dua memiliki satu ikatan pi dan ikatan rangkap tiga memiliki dua ikatan pi. Ikatan pi dihasilkan dari tumpang tindih orbital-orbital. Ikatan pi memiliki sifat yang lebih baur dari ikatan sigma. Elektron-elektron pada ikatan pi kadang kala dirujuk sebagai elektron pi. Fragmen molekul yang dihubungkan dengan ikatan pi tidak dapat diputar tanpa memutuskan ikatan pi tersebut, karena perputaran akan merusak orientasi paralel dari orbital-orbital p yang membentuk ikatan pi.
Kasus khusus[sunting | sunting sumber]
Ikatan pi tidak seperlunya menghubungkan sepasang atom yang juga memiliki ikatan sigma.
Pada beberapa kompleks logam, interaksi pi antara atom logam dengan orbital antiikat pi alkana dan alkena membentuk ikatan pi.
Dalam beberapa kasus ikatan rangkap banyak antara dua atom, tidak terdapat ikatan sigma sama sekali, yang ada hanyalah ikatan pi. Contohnya meliputi diferri heksakarbonil (Fe2(CO)6), dikarbon (C2) dan borana B2H2. Dalam senyawa-senyawa ini, ikatan pusat hanya terdiri dari ikatan pi, dan agar mencapai wilayah tumpang tindih yang maksimum, panjang ikatan menjadi lebih pendek dari yang diperkirakan
Teori Ikatan Valensi (Valence Bond Theory)
Menurut teori Heitler-London :
ikatan kovalen dinyatakan bahwa elektron-elektron yang digunakan bersama menempati orbital taom yang saling bertumpangsuh (overlap). Menurut Heitler-London, ikatan terjadi dengan cara tumpangsuh antar orbital atom sehingga elektron terlokalisasi. Agar diperoleh molekul yang stabil, kedua elektron harus mempunyai spin yang berlawanan dengan harga minimum pada kurva energy potensial. Sedang pada spin yang sejajar tidak terbentuk ikatan yang stabil.
Menurut teori Pauling-Slater :
Kekuatan ikatan bergantung pada derajat tumpangsuh orbital yang terlibat dalam pembentukan ikatan. Makin besar derajat tumpangsuh, maka akan semakin kuat ikatannya, sedangkan arah ikatan sesuai dengan kedudukan elektron berada.
Fungsi-fungsi gelombang dari orbital s & orbital p dapat dikombinasikan untuk membentuk orbital atom hibrida.
Tumpangsuh antara dua orbital –s tidak kuat karena distribusi muatan yang berbentuk bola; pada umumnya ikatan s-s relative lemah. Orbital –p dapat bertumpangsuh dengan orbital –s atau orbital –p lainnya dengan lebih efektif, karena orbita-orbital –p lebih terkonsentrasi pada arah tertentu.
Tumpangsuh antar orbital-orbital dapat menghasilkan ikatan sigma dan ikatan phi. ikatan sigma dapat terbentuk dari tumpangsuh orbital s-s, p-p, dan s-p. Elektron ikatan dalam ikatan sigma terletak di sekitar garis (khayal) yang menghubungkan inti kedua atom. Ikatan phi dihasilkan karena tumpangsuh dua orbital –p yang berdekatan dan sejajar. Kekuatan ikatan sigma lebih besar daripada ikatan phi.
orbital s-s membentuk ikatan sigma

orbital p-p sejajar membentuk ikatan phi
 orbital s-p membentuk ikatan sigma
orbital s-p membentuk ikatan sigma
 orbital p-p membentuk ikatan sigma
orbital p-p membentuk ikatan sigma



Hibridisasi
Merupakan proses penggabungan orbital atom dengan tingkat energy berbeda menjadi tingkat energy yang relative sama.
Teori ikatan valensi menjelaskan bentuk molekul trigonal bipiramid pada ikatan PF5. Menurut teori VSEPR, PF5 mempunyai bentuk geometri AX5, jadi senyawa tersebut membutuhkan 5 atom untuk berikatan membentuk molekul trigonal bipiramid. Karena atom P mempunyai orbital d kosong maka dapat berhibridisasi membentuk sp3d untuk berikatan membentuk molekul PF5.

· Manfaat dari Teori Ikatan Valensi adalah :
Ø Menjelaskan perbedaan ikatan sigma dan ikatan phi
Ø Menjelaskan bentuk molekul suatu senyawa
Ø Menjelaskan proses hibridisasi pada suatu atom
Langganan:
Komentar (Atom)




